1.- Masa atómica
Pre-conocimiento

|
|
Llave. |
¿Estás seguro de que tienes una idea del tamaño del átomo?.
Imagina que tienes una llave metálica en tus manos, ¿sabes cuánto tendrías que aumentarla para poder ver a simple vista sus átomos?.
Pues si la llave se aumentara hasta un tamaño similar al del planeta Tierra, entonces los átomos se verían más pequeños que una cereza.
Los minúsculos átomos son la fracción más pequeña de materia y como tal, se caracterizarán por su masa y su volumen. Pero la masa de los átomos es tan pequeña que no se puede medir como en los cuerpos macroscópicos, ni por supuesto en las unidades habituales, en kilogramos (kg), ya que esta unidad es demasiado grande para medir la masa de un átomo.
Por ello, para medir la masa de los átomos se define una unidad muy pequeña, la unidad de masa atómica unificada (u) o Dalton (Da), que equivale a la doceava parte de la masa de un átomo de C-12.
Actividad
|
|
Átomo de Li. |
La masa atómica es la masa de un átomo, expresada en unidades de masa atómica unificada. Esta masa, como es natural, dependerá de los protones, neutrones y electrones que tenga el átomo.
El problema es que casi todos los elementos están constituidos por varios isótopos, que tienen diferente número de neutrones, con lo que las masa de los isótopos difieren ente sí y por tanto tiene distinta masa atómica.
Por ello se define la masa atómica relativa o peso atómico de un elemento, como la media ponderada de las masas atómicas de los isótopos que lo constituyen, por supuesto medida en unidades de masa atómica unificada (u) ó en Dalton (Da).
Pre-conocimiento
Se conocen dos isótopos estables del lítio, cuyas abundancias y masas relativas se indican en la siguiente tabla:
| Isótopo | Abundancai relativa |
Masa atómica |
| Li-6 | 7,42 % |
6,015 u |
|
Li-7 |
92,58 % | 7,016 u |
Por lo tanto, la masa atómica relativa del litio será: 6,015 (7,42/100) + 7,016 (92,18/100) = 6,941 u
Actividad
La masa atómica relativa de un elemento es la media ponderada de las masas atómica de los isótopos que tiene.
En esa media ponderada se tiene en cuenta la abundancia de cada uno de ellos.
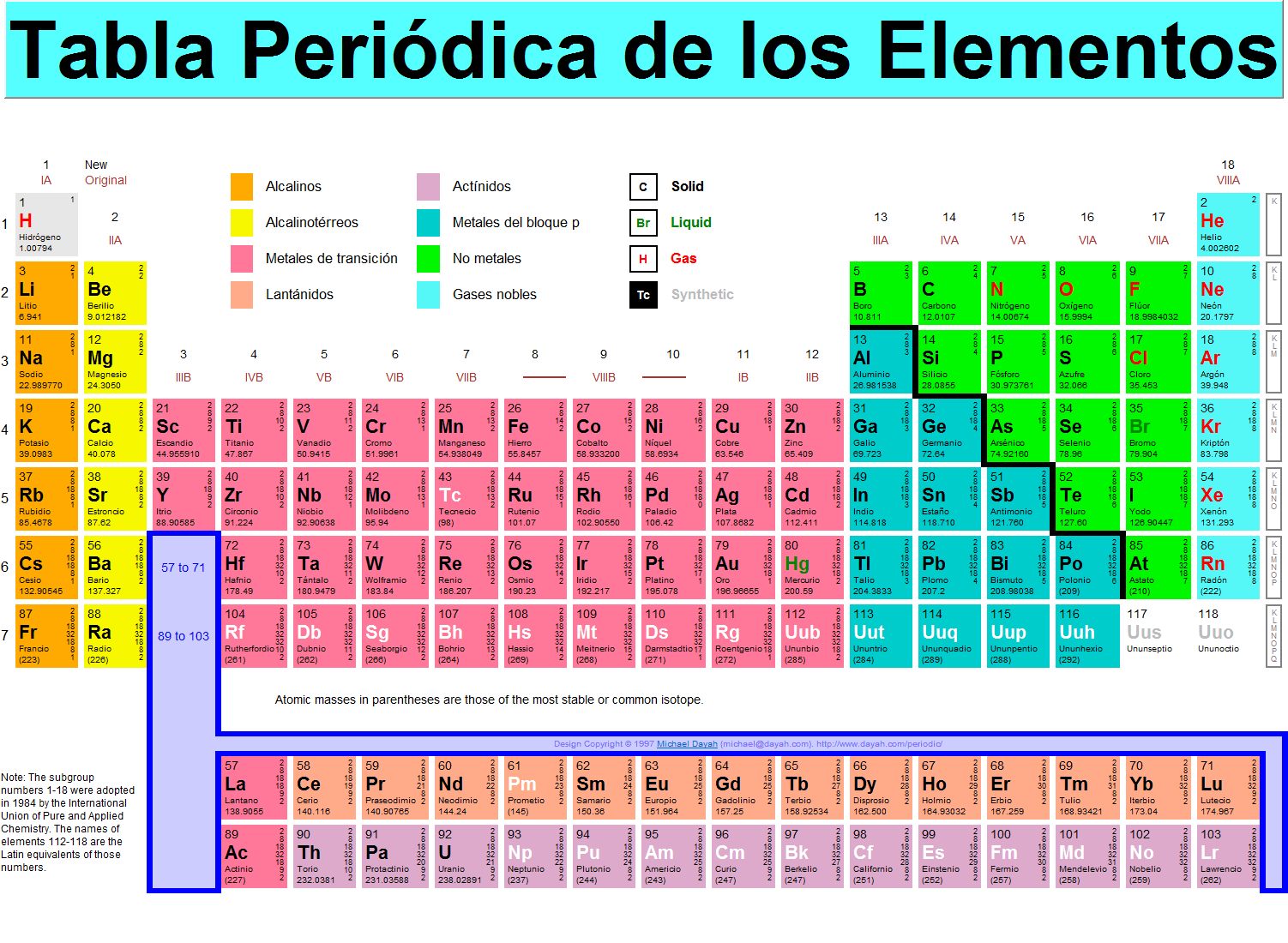
Las masas atómicas relativas, de los diferentes elementos se han determinado y están disponibles en la tabla periódica. Haz clic sobre ella para verla de mayor tamaño.
| Tabla peririódica de Michael Dayah. Permiso uso no lucrativo |