4.1 Puentes de hidrógeno
Hay un tipo de dipolo particularmente importante, ya que da lugar a interacciones dipolares intensas. El enlace de hidrógeno no sólo se presenta en el agua, sino también en los alcoholes, los ácidos orgánicos, los fenoles que contienen grupos O-H, en las amidas, aminas y en el amoníaco, que contienen grupos N-H y en el ácido fluorhídrico H-F (enlaces del H con los elementos más electronegativos y de menor tamaño).
Estas interacciones son decisivas en muchos procesos fundamentales que se realizan en los organismos vivos.
 |
|
| Imagen 12 Michel Mañas, Creative commons |
Simulación 3 Proyecto Tiger, Uso educativo |
| |
| Imagen 13 Kallerna, Creative commons |
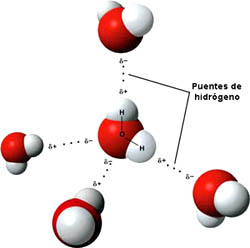
Se suele llamar puente de hidrógeno o enlace por puente de hidrógeno, pero no deja de ser una fuerza intermolecular particularmente intensa: las sustancias que forman puentes de hidrógeno presentan puntos de fusión y ebullición más altos de lo esperado, debido precisamente a la intensidad de ese tipo de interacción.
Fíjate en cómo se orientan las moléculas de agua: el extremo negativo del dipolo, situado en el oxígeno, se orienta con respecto a los positivos de otras moléculas de agua, situados en los hidrógenos.
La especial distribución de los puentes de hidrógeno en el estado sólido da lugar a las diferentes formas de cristalización del hielo, algunas de las cuales puedes ver en la imagen de la derecha.
AV - Reflexión
AV - Pregunta Verdadero-Falso
Retroalimentación
Verdadero
Retroalimentación
Verdadero
Retroalimentación
Verdadero
Retroalimentación
Falso