6.3 Sustancias covalentes
En las sustancias covalentes se forman estructuras gigantes de átomos unidos mediante enlace covalente. Los ejemplos más característicos son el diamante, cuya estructura ya has visto, la sílice (SiO2) con la misma estructura tetraédrica y átomos de silicio unidos a los de oxígeno, y el grafito.
Como los enlaces son covalentes, muy fuertes, las redes covalentes son difíciles de destruir, lo que se traduce en que los puntos de fusión son altos, la dureza elevada y la solubilidad nula.
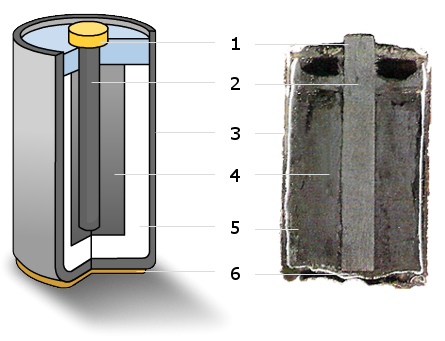
El grafito tiene una propiedad muy característica: tiene una apreciable conductividad de la corriente eléctrica, por lo que se utiliza para hacer electrodos (en las pilas más conocidas, de 1,5 voltios, el electrodo central, conectado al borne positivo de la pila y marcado con el número 2, es una barra de grafito).
 |
 |
 |
| Imagen de Jacek FH en Wikimedia. CC | Imagen de SGov en Wikimedia. CC0 | Imagen de Anton en Wikimedia. CC |
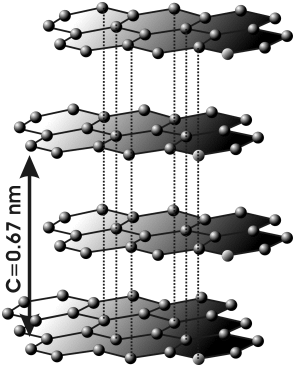
Si te fijas en la imagen, verás que el grafito consta de láminas de anillos hexagonales en los que los electrones tienen cierta movilidad (como en el benceno), pero como los anillos están unidos, pueden pasar de un anillo a otro contiguo. Cuando el grafito se conecta a una diferencia de potencial, los electrones tienden a desplazarse hacia la zona de mayor potencial (polo positivo), pasando de un anillo a otro.
DUREZA Y FRAGILIDAD.
Se entiende por dureza la resistencia que ofrece un cuerpo a ser rayado. Los sólidos covalentes presentan una elevada dureza, de hecho, el diamante se toma como valor máximo en la escala de dureza.
La elevada dureza de las sustancias covalentes, puede explicarse teniendo en cuenta que para rayar un sólido covalente, es necesario arrancar unos cuantos átomos del sólido, para lo que hay que romper fuertes enlaces covalentes, por lo que presentan una gran resistencia al rayado.
ESTADO DE AGREGACIÓN.
Todas las sustancias covalentes son sólidas a temperatura ambiente, presentando unos elevados puntos de fusión y ebullición.
Esto puede explicarse porque, para separar las partículas del sólido covalente, es necesario romper fuertes enlaces covalentes, para lo que se requiere una elevada temperatura.
| Imagen de Schwarzm en Wikimedia. CC |
CONDUCTIVIDAD ELÉCTRICA.
Las sustancias covalentes en general son aislantes, pues los electrones que comparten entre átomos están muy localizados entre átomos concretos.
No obstante, hay algunas sustancias covalentes como el grafito que presentan una estructura laminar, en anillos, dentro de los cuales pueden tener cierto movimiento los electrones, lo que le confiere cierta conductividad a lo largo de las láminas.
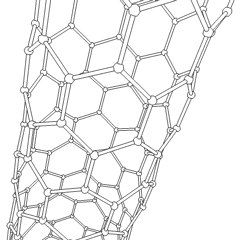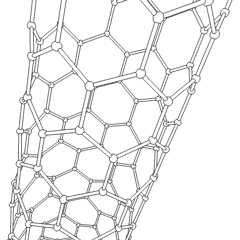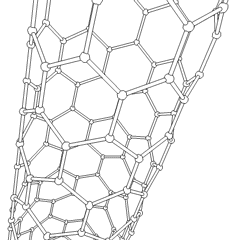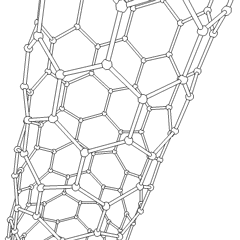
Utilizando esta propiedad del grafito, se han desarrollado los nanotubos de grafito, que son estructuras laminares de grafito enrolladas sobre sí mismas, dando lugar a estructuras como la que ves en la figura.
Los nanotubos de carbono son las fibras más fuertes que se conocen, un solo nanotubo es de 10 a 100 veces más fuerte que el acero y poseen propiedades eléctricas muy interesantes, conduciendo la corriente eléctrica cientos de veces más eficazmente que los tradicionales cables de cobre. Si quieres saber más sobre los nanotubos puedes hacer clic en la animación de la derecha para acceder a un vídeo.
SOLUBILIDAD.
Las sustancias covalentes son prácticamente insolubles en cualquier tipo de disolvente.
Esta insolubilidad puede explicarse teniendo en cuenta que para disolver un sólido el disolvente tiene que arrancar sucesivamente las partículas del sólido.