6.2 Sustancias metálicas
Recuerda que un enlace metálico es un enlace químico que mantiene unidos a los átomos metálicos. Los átomos metálicos, al tener muy poca electronegatividad y ser muy electropositivos, pierden los electrones de la capa de valencia, que pasan a formar una nube de electrones y se sitúan formando una red muy compacta inmersa en esa nube de electrones. Al perder todos los electrones de la capa de valencia, la anterior pasa a ser la capa de valencia y queda con una configuración electrónica estable como la del gas noble.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas.
 |
| Imagen de Scott Edharten Wikimedia. CC0 |
CONDUCTIVIDAD ELÉCTRICA.
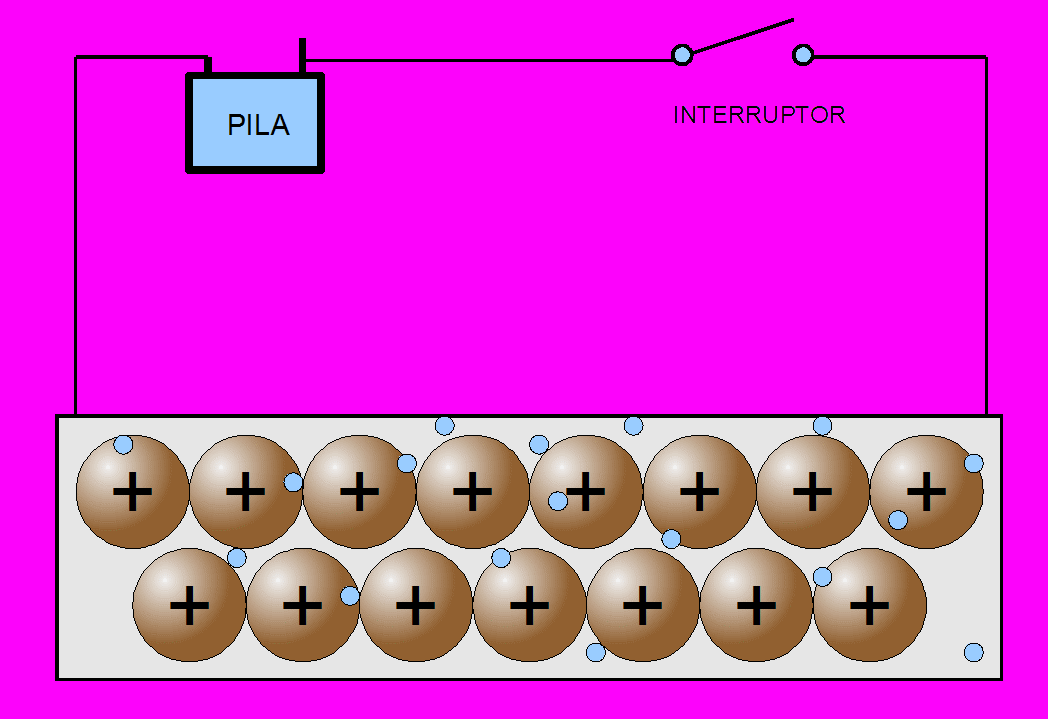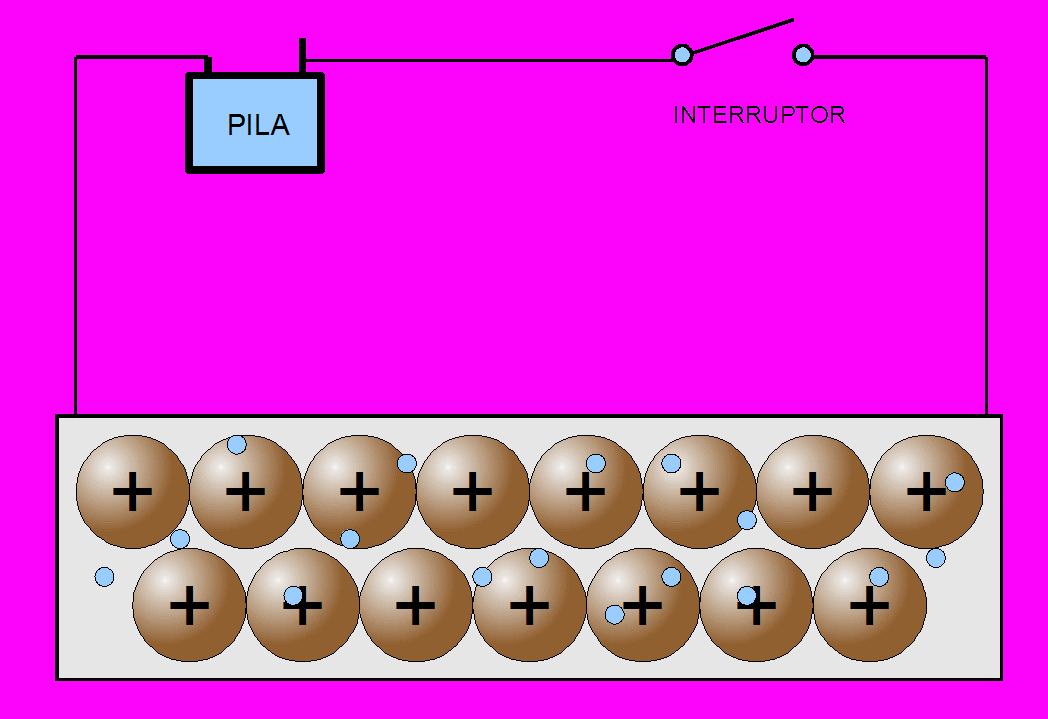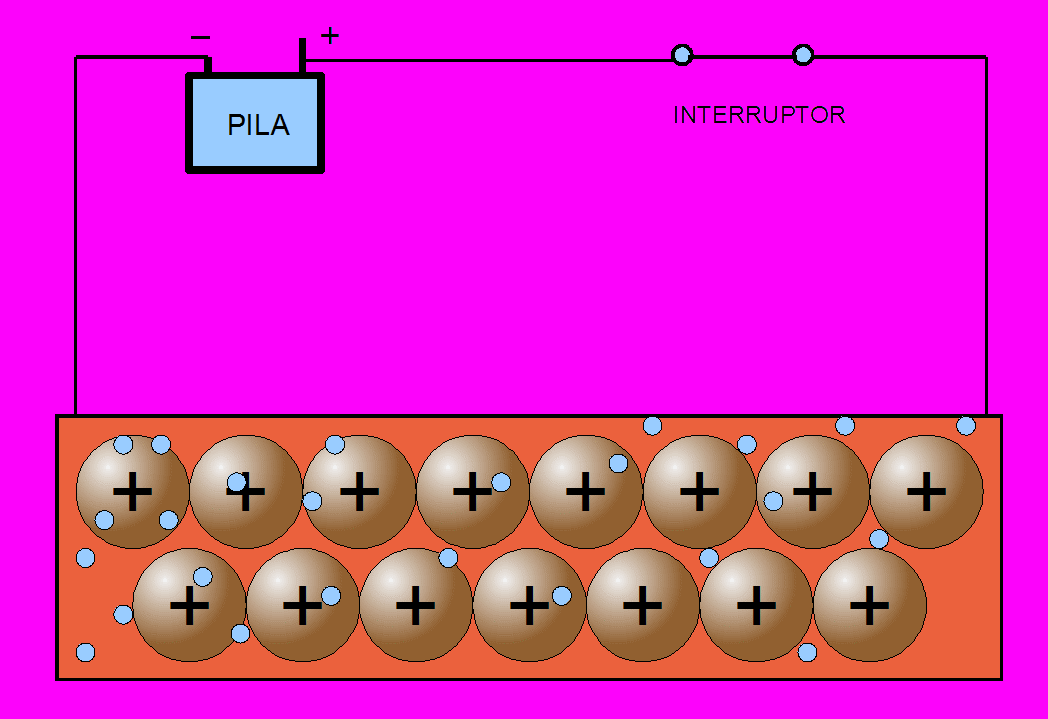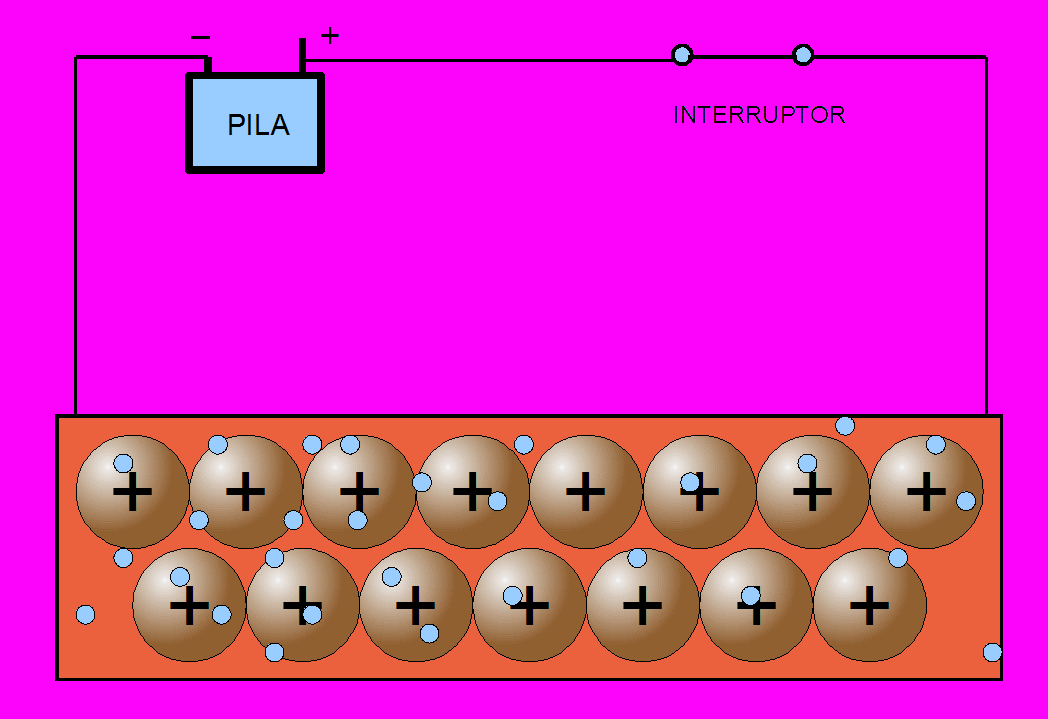
La propiedad más característica de los metales, es la conducción de la corriente eléctrica: por agitación térmica los electrones se mueven desordenadamente en todas direcciones y a lo largo de toda la red, de acuerdo con el modelo de la nube electrónica o del gas electrónico.
 |
| Simulación del Proyecto Newton, CC |
Como los electrones tiene muy poca masa (más de cien mil veces menor que la de un ion de cobre), se mueven con facilidad entre los iones. Si se someten dos puntos de un metal a una diferencia de potencial, los electrones se mueven con facilidad hacia el polo positivo, de mayor potencial. Este flujo de partículas cargadas en movimiento -electrones en este caso- es precisamente la corriente eléctrica.
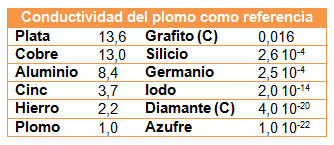
En la tabla siguiente tienes los datos de conductividad eléctrica de varias sustancias (metales y no metales), tomando como referencia unidad, la conductividad del plomo. Fíjate en que la variación es muy grande, desde 13,6 de la plata, el mejor conductor, hasta 10-22 del azufre, que es un aislante. Observa los valores del grafito, que tiene una conductividad apreciable y por eso se utiliza para fabricar electrodos, y el silicio, que es un semiconductor, fundamental en la industria electrónica.
 |
| Imagen de Pearle en Wikipedia. CC |
ESTADOS DE AGREGACIÓN.
Todas las sustancias metálicas son sólidas a temperatura ambiente, con excepción del mercurio. Este hecho indica que las fuerzas de cohesión de los átomos metálicos son importantes.
El punto de fusión es muy variable, desde el entorno de 50-100 ºC de los alcalinos (28 ºC el cesio), pasando por el estaño, usado en soldadura electrónica, hasta los 3410 ºC del wolframio, utilizado en filamentos de bombillas incandescentes.
DUREZA Y FRAGILIDAD.
Su dureza es media o baja, dependiendo de la intensidad del enlace: en general, las más duras tienen puntos de fusión más altos.
Si se trata de átomos pequeños que se ordenan en redes muy compactas, la densidad es muy elevada, como ocurre en el osmio, iridio y platino, superiores a 22 g/cm3 , aunque en algunos casos como litio, sodio o potasio, flotan en el agua (densidad menor de 1 g/cm3).
No son frágiles como sucede con las sustancias iónicas, sino que resultan maleables y dúctiles, pudiendo cambiar su forma al golpearlos. En algunos casos, incluso se pueden doblar con la mano (hilos de cobre, chapas finas de aluminio, etc). Esto se debe a que al deformar un poco la red se obtiene una estructura espacial de los átomos similar a la inicial (por el contrario, al deformar una red iónica se enfrentaban iones del mismo signo, que al repelerse producían su fractura, como ya has visto los sólidos iónicos sí son frágiles).
SOLUBILIDAD.
No se disuelven en ningún líquido. En agua los metales no se disuelven, pero algunos de ellos reaccionan con ella formando óxidos o hidróxidos. Es decir, reaccionan químicamente con el liquido (agua) y se disuelven, pero al evaporar el líquido no se recupera la sustancia inicial, ya que se han formado otras sustancias. Por ejemplo, el sodio reacciona con violencia con el agua, formándose hidróxido de sodio en disolución y desprendiéndose gas hidrógeno. Al evaporar la disolución, se recupera hidróxido de sodio y no el metal.
OTRAS PROPIEDADES.
Su calor específico es muy bajo; es decir, se calientan con facilidad al comunicarles energía en forma de calor. Como además los metales conducen muy bien el calor, no sólo aumentan apreciablemente su temperatura, sino que lo hacen muy deprisa. Por esta razón se utilizan en cocina para fabricar cacerolas, ollas y sartenes.
 |
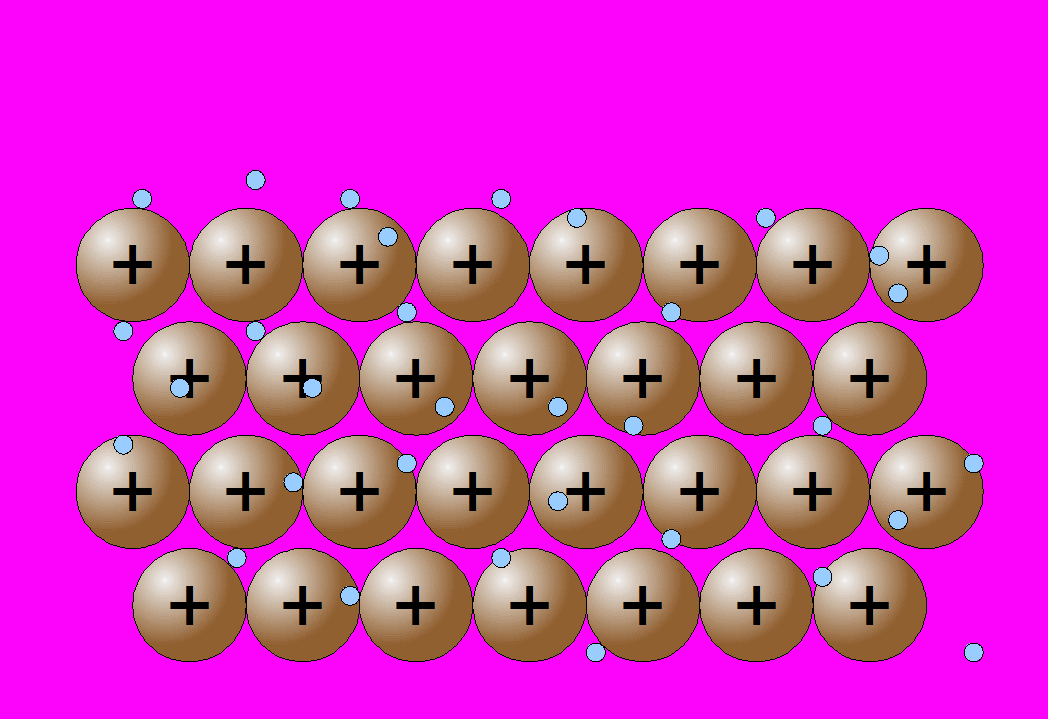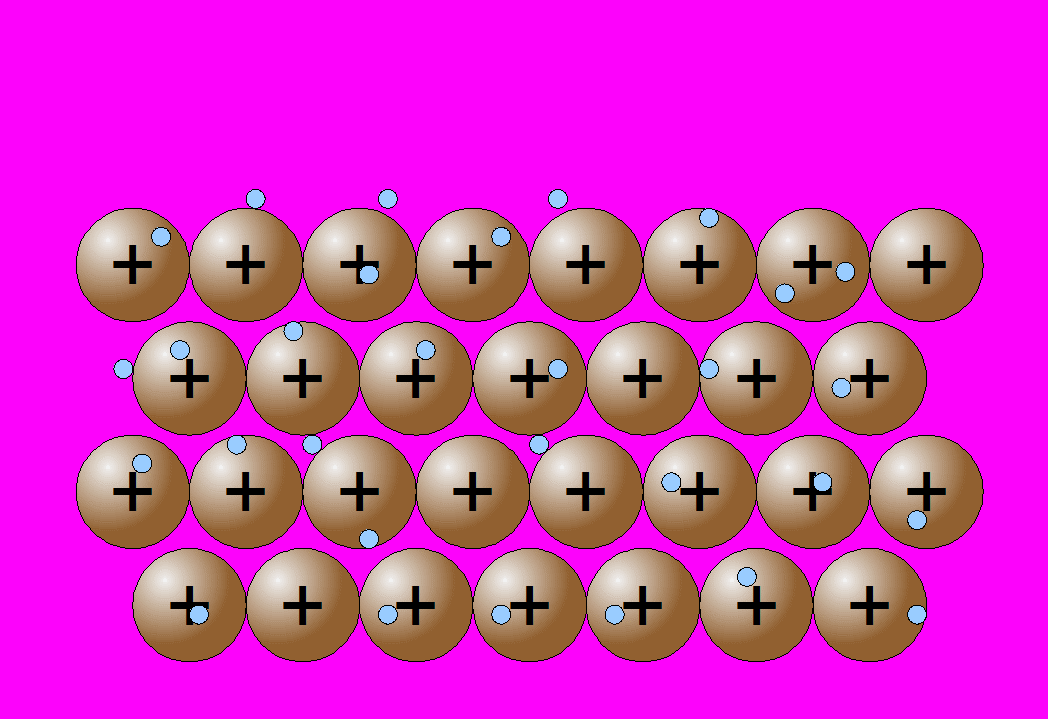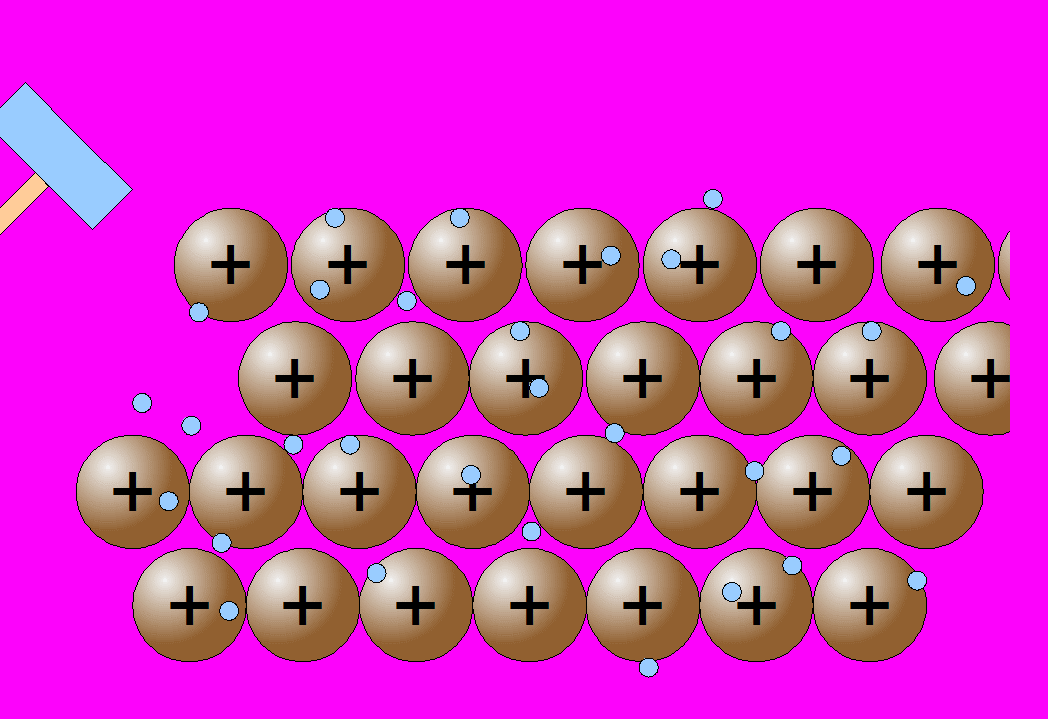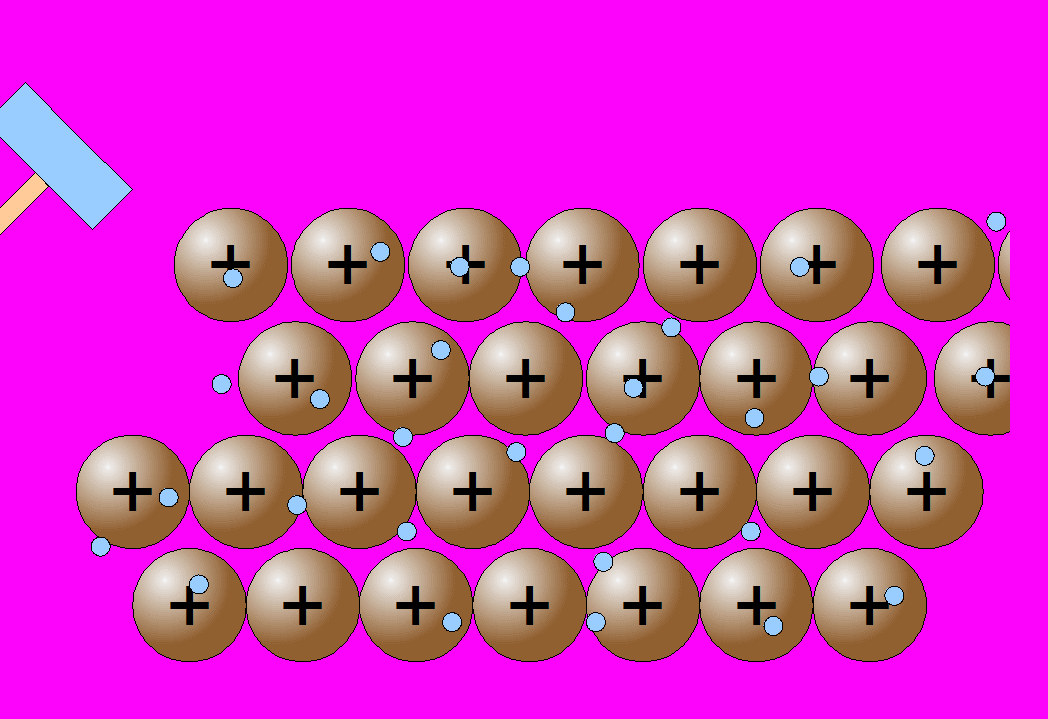 |
| Conductividad eléctrica | Ductilidad y maleabilidad |
Importante
De forma general, los metales presentan las siguientes propiedades:
- Son opacos y presentan brillo característico.
- Conducen el calor y la electricidad.
- Son dúctiles y maleables.
- Suelen ser bastante densos.
- Suelen tener puntos de fusión y ebullición altos.
AV - Pregunta Verdadero-Falso
Retroalimentación
Verdadero
La plata es un metal y conduce la corriente eléctrica gracias a la movilidad de los electrones de la nube de carga que está deslocalizada por toda su estructura cristalina. De hecho, la plata es el elemento que mejor conduce la electricidad.Retroalimentación
Falso
El oro es un metal muy dúctil y maleable y con el se pueden fabricar hilos, por ejemplo para hacer cadenas, y láminas como el pan de oro.Retroalimentación
Falso
El hierro es bastante más denso que el agua y no puede flotar en ella. Todos los metales son más densos que el agua, excepto el litio, el sodio y el potasio. La alta densidad de los metales se debe a que sus átomos están muy juntos, sus estructuras son muy compactas.Retroalimentación
Falso
El cloruro de sodio es un compuesto iónico y sólo conduce la corriente eléctrica cuando está fundido.Retroalimentación
Verdadero
Se utiliza generalmente una cuchara de madera porque, como ya hemos visto, el metal conduce el calor y nos quemaríamos las manos.Curiosidad
 |
| Imagen de Tomihahndorfen Wikimedia. CC |
Si te fijas en la ampolla de cesio de la fotografía, verás que hay una parte que está fundida. No es de extrañar, el cesio o el galio se pueden fundir fácilmente en la palma de la mano ya que sus puntos de fusión son inferiores a 30ºC. La temperatura de fusión del litio (181ºC), sodio (97,8ºC), potasio (63,5ºC) y rubidio (38,9ºC) son también bajas. El plomo se puede fundir con la llama de una cerilla y una hoja de estaño introducida en el fuego se convierte al instante en una gota de estaño líquido. En cambio, para fundir el volframio es necesaria una temperatura mayor a 3000ºC. Por eso los filamentos de las bombillas se fabrican con este material. Como ves, el punto de fusión de los metales es variable, pero la mayoría de ellos presentan puntos de fusión altos.
Curiosidad
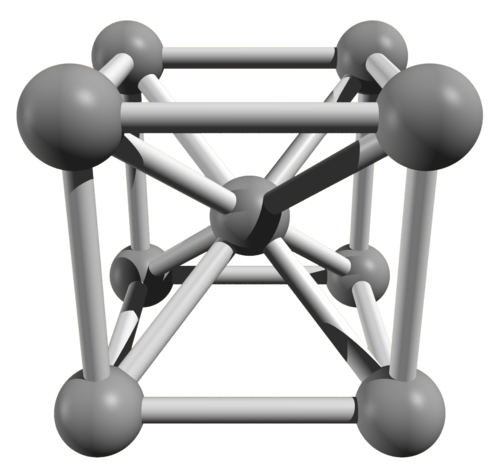
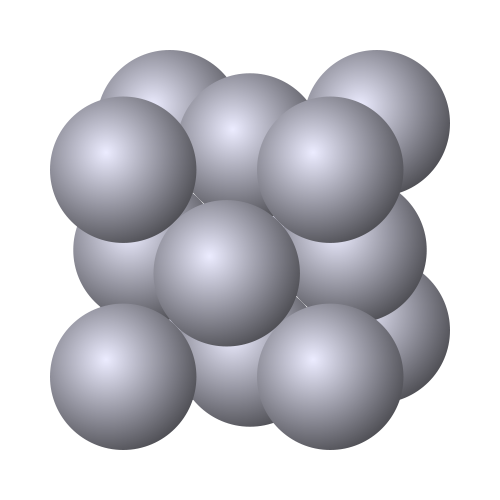
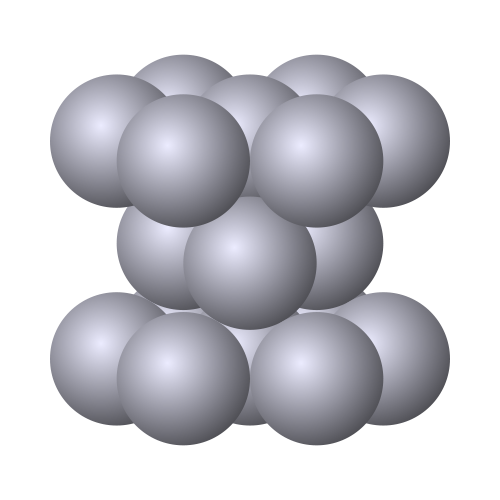
La mayoría de los metales cristalizan en alguna de las tres estructuras cristalinas representadas abajo: estructura cúbica centrada en el cuerpo (por ejemplo el sodio), estructura cúbica centrada en las caras (por ejemplo el oro o la plata) y estructura hexagonal compacta (por ejemplo el magnesio o el zinc).
Algunos metales cambian de estructura con la temperatura. Así, el hierro presenta una estructura cúbica centrada en el cuerpo hasta una temperatura de 912ºC. A partir de esta temperatura, cambia a una estructura cúbica centrada en las caras, para volver a tener una estructura cúbica centrada en el cuerpo a unos 1400ºC.
 |
 |
 |
| Estructura cúbica centrada en el cuerpo |
Estructura cúbica centrada en las caras |
Estructura hexagonal compacta |