5. Fuerzas intermoleculares
Pre-conocimiento
Las propiedades de las sustancias moleculares (con enlace covalente) indican que las fuerzas entre las moléculas que las forman son, en general, mucho menos intensas que las que hay entre las partículas de las sustancias iónicas, metálicas o covalentes: la característica principal es que son gaseosas o líquidas a temperatura ambiente, y si son sólidas, son blandas y su dureza es baja o media.
Esas fuerzas intermoleculares reciben el nombre de fuerzas de Van der Waals, y son las responsables de las propiedades físicas de las sustancias moleculares y de su estado de agregación: si no existieran, las moléculas se moverían desordenadamente por agitación térmica, sin ningún tipo de atracción entre ellas, y el estado físico sería siempre el gaseoso. En la naturaleza hay muchas sustancias moleculares en estado líquido, como el alcohol de quemar, la acetona, el ácido acético, el agua o la gasolina, o sólido, como el iodo, la mantequilla, etc. Estos ejemplos indican que estas fuerzas intermoleculares son muy frecuentes en la naturaleza.
Actividad
Hay dos tipos de interacciones en las sustancias moleculares:
- Enlaces covalentes: interacciones entre los átomos que dan lugar a una molécula. Son las que determinan las propiedades químicas de la sustancia.
- Fuerzas intermoleculares: interacciones eléctricas que unen las moléculas. Son mucho más débiles que las anteriores, y determinan las propiedades físicas de la sustancia.
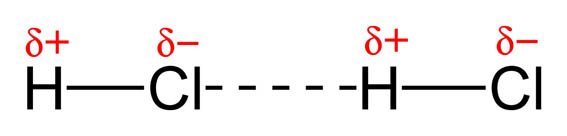
Las fuerzas intermoleculares se deben a interacciones entre dipolos, por lo tanto, serán tanto más intensas cuanto mayor sea la polaridad de las moléculas. Los dipolos se orientan unos con respecto a los otros, de forma que los extremos positivos de unas moléculas se acercan a los negativos de otras, produciéndose una cierta ordenación en la sustancia, lo que le confiere cierta estabilidad.
 |
 |
| Imagen de Benjah-bmm27 en Wikimedia. CC0 | Imagen de Diego JP, Creative commons |
Así, estas fuerzas intermoleculares, unen ordenadamente las moléculas de la sustancia, por lo que son las responsables de que algunas sustancias moleculares sean líquidas o sólidas a temperatura ambiente, al ser estas fuerzas intermoleculares lo suficientemente intensas como para mantener la estructura del líquido o el sólido, respectivamente.
Estas Interacciones dipolares se dan cuando las moléculas son polares, como sucede en el caso del HCl, agua, amoniaco, etc. Cuanto más polar sea la molécula, más intensas son la fuerzas intermoleculares.
| Imagen de Diego JP, Creative commons |
Además existen fuerzas de dispersión, se deben a que las nubes electrónicas de las moléculas no están fijas, sino que se van distribuyendo entre los átomos unidospor enlace covalente. Debido a esas redistribuciones, en un momento dado se puede producir en las moléculas una cierta separación de cargas, un dipolo instantáneo, que además induce dipolos instantáneos en las moléculas cercanas. Estos dipolos se orientan entre sí, dando lugar a una cierta interacción entre las moléculas: las fuerzas dispersivas o de dispersión.
Estas fuerzas de dispersión son poco intensas, son tanto mayores cuanto mayor sea el número de electrones de la molécula, es decir, aumentan con la masa molecular.
Actividad
Las fuerzas intermoleculares (fuerzas de Van der Waals) pueden ser:
- Interacciones dipolares, aumentan al hacerlo la polaridad de la molécula.
- Fuerzas dispersivas: aumentan con la masa molecular
AV - Reflexión
Justifica razonadamente los puntos de ebullición de las sustancias que se indican en la tabla (H2, HCl y Cl2). Los valores de los puntos de ebullición son: -253 ºC, -34 ºC y 48 ºC, ¿a quién corresponde cada una de estos valores?.
| Sustancia | Punto de ebullición |
| H2 |
|
| HCl |
|
| Cl2 |