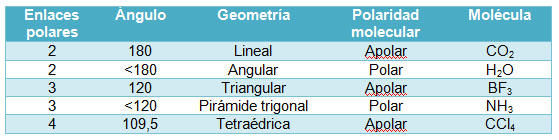
3.3 Polaridad de las moléculas
Pre-conocimiento
|
|
| Imagen de dominio público |
La polaridad es una propiedad de las moléculas que representa la separación de las cargas eléctricas (positiva y negativa) en la misma. Esta propiedad está íntimamente relacionada con otras propiedades como la solubilidad, punto de fusión, punto de ebullición, fuerzas intermoleculares, etc.
Así en las sustancias moleculares, es muy importante conocer la polaridad de la molécula, pues conociéndola, se pueden explicar propiedades como su solubilidad en agua y sus puntos de fusión y ebullición.
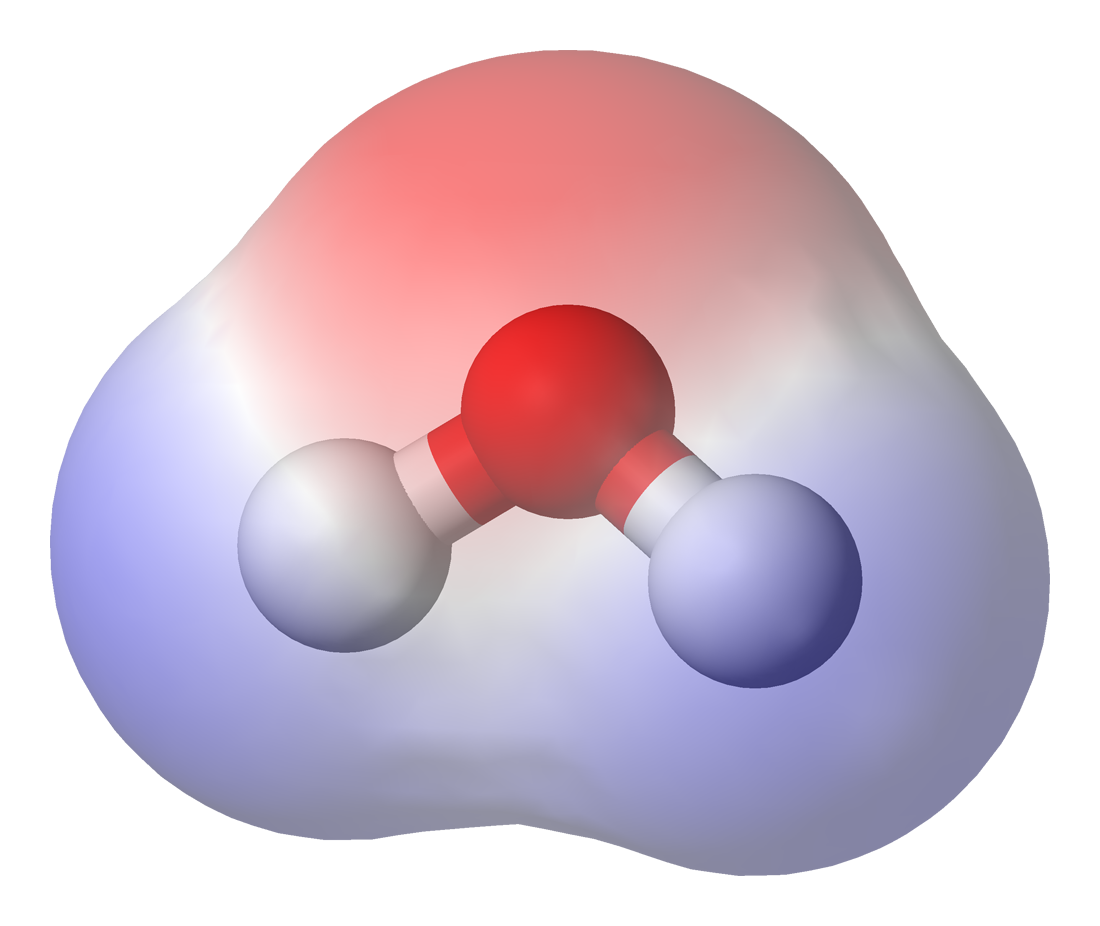
Un ejemplo común de sustancia polar es el agua (H2O). Los electrones compartidos entre los átomos de hidrógeno y el oxígeno, son atraídos más fuertemente por el oxígeno y están, en realidad, más cerca del núcleo del oxígeno que de los de los hidrógenos. Por esto, la molécula de agua tiene una carga negativa en el centro (color rojo) y una carga positiva en sus extremos (tono azul).
Cuando los dos átomos unidos mediante enlace covalente tienen electronegatividad diferente, los electrones están más cerca del átomo más electronegativo.
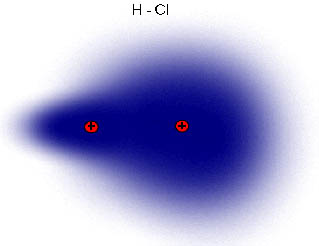
Observa en la imagen lo que sucede con el cloro y el hidrógeno: los electrones están más cerca del cloro, más electronegativo, que del hidrógeno. También se suele indicar una cierta densidad de carga negativa sobre el cloro y positiva sobre el hidrógeno, donde delta ( , que representa la densidad de carga) es menor que la unidad, ya que si fuera la unidad, se habrían formado dos iones.
, que representa la densidad de carga) es menor que la unidad, ya que si fuera la unidad, se habrían formado dos iones.
Esta distribución de dos cargas de la misma magnitud y signo contrario se llama dipolo, y su efecto se mide por el momento dipolar, magnitud vectorial cuyo módulo es el valor de las cargas por la distancia que las separa. Al tratarse de una magnitud vectorial, se representa por un vector orientado hacia el elemento más electronegativo del dipolo (H→Cl).
 |
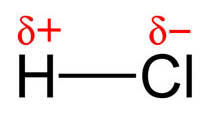 |
| Imagen de Lanzi en Wikimedia. CC | Imagen de elaboración propia |
AV - Pregunta de Elección Múltiple
Cuando una molécula es diatómica (formada por sólo dos átomos), estudiar su polaridad, es muy fácil: si los átomos tienen la misma electronegatividad, el enlace y la molécula son apolares, y si son diferentes, el enlace y la molécula serán polares. Por ejemplo, son los casos respectivos de Cl2 y de HCl.
Si hay más de dos átomos unidos, puede darse el caso de que teniendo enlaces polares la molécula sea polar, como es el caso del agua, o apolar, como sucede en el dióxido de carbono. ¿A qué se debe?
Si una molécula tiene varios enlaces polares, pueden compensarse sus separaciones de cargas (sus momentos dipolares de enlace), según sea la geometría de la molécula. Fíjate en el caso del CO2, que es una sustancia apolar, a pesar de que los enlaces entre el carbono y el oxígeno son polares, ya que el oxígeno es más electronegativo que el carbono, y los electrones de enlace están desplazados hacia él. La causa de que la molécula sea apolar es que es simétrica, su geometría es lineal, con lo que los dos vectores momento dipolar de enlace se anulan mútuamente.
Por el contrario, como el agua tienen geometría angular, los dos momentos dipolares de enlace no se anulan, y la molécula es polar (se representa el momento dipolar resultante).
Si hay más de dos enlaces, el análisis es similar: el NH3 es polar debido a su geometría de pirámide trigonal, mientras que el BH3 es apolar, por ser triangular plana (la resultante de tres vectores de igual módulo que forman un ángulo de 120º es nula).
El CCl4 es apolar por la misma razón: la resultante de los cuatro vectores momento dipolar de enlace es nula si su geometría es tetraédrica.
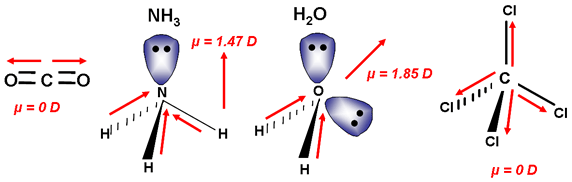 |
| Imagen de Diego JP, Creative commons |
En la tabla siguiente puedes ver los casos que se plantean en casos muy conocidos de moléculas del tipo AB2, AB3 y AB4, que tienen dos, tres o cuatro enlaces polares iguales.