3.1 Formación de enlaces covalentes
Llegados aquí, es preciso que recuerdes la conocida regla del octeto:
"Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico".
Esta teoría tan simple permite explicar de una manera sencilla por qué ocurre el enlace entre átomos y es especialmente útil al estudiar el enlace, de cualquier tipo, pero particularmente el enlace covalente entre átomos.
Cuando los átomos de elementos no metálicos, con una elevada electronegatividad, es decir, que tienen mucha tendencia a aceptar electrones y ninguna a perderlos, se aproximan, como los dos átomos tienen mucha tendencia a aceptar electrones, cada uno, intenta aceptar un electrón del otro átomo, pero como el otro no lo pierde, entonces entre los dos comparten ese par de electrones, formando un enlace covalente.
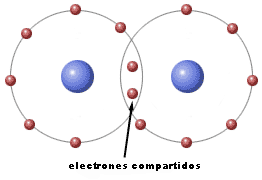 |
| Imagen de elaboración propia |
El enlace covalente tiene lugar cuando los átomos que se unen comparte electrones, consiguiendo así, una estructura como la del gas noble más próximo. Pero dependiendo de cómo se compartan esos electrones, podemos encontrar diferentes tipos de enlace covalente:
| Puro o apolar |
|
Si los átomos que comparten electrones tienen la misma tendencia a atraer los electrones hacia sí, tienen la misma electronegatividad, entonces los electrones se comparten por igual entre los dos átomos. |
||
| Polar |
|
Si la electronegatividad de los átomos es ligeramente diferente, entonces, uno de ellos atrae los electrones hacia sí, con más intensidad que el otro, por lo que no se comparten por igual, estarán más cerca de uno, el más electronegativo, que del otro. Aparece pues cierta carga negativa sobre el átomo más electronegativo (atrae los electrones hacia sí, con más fuerza que el otro átomo) y cierta carga positiva sobre el menos electronegativo (atrae los electrones hacia sí con menos fuerza que el otro átomo). |
||
| Múltiple |
|
Se comparte más de un par de electrones entre los átomos, puede ser doble o triple. Al ser el enlace más intenso, los átomos se unen más fuertemente, aumentando la energía de enlace y disminuyendo la distancia de enlace. Cuando entre dos átomos comparten dos pares de electrones se produce un enlace covalente doble. En este caso, cada átomo aporta dos electrones. Cuando cada átomo aporta tres electrones, se comparten tres pares de electrones entre dos átomos y el enlace covalente se denomina triple. |
||
| Dativo |
|
También es posible que el par de electrones que van a compartir entre dos átomos, sea aportado por uno sólo de los dos átomos. El enlace dativo tiene lugar cuando uno de los átomos ya tiene completa su capa de valencia y al otro átomo le falta un par de electrones para completarla. |
AV - Reflexión
Objetivos
La regla del octeto no siempre se cumple
A pesar de la sencilla explicación que esta teoría da al enlace entre átomos, desgraciadamente tiene algunas excepciones, como es el caso de la unión de átomos con pocos electrones en la última capa, que no pueden conseguir ocho electrones, no pueden compartir tantos electrones como para conseguir los ocho electrones en la capa de valencia. Son ejemplos de excepción de la regla del octeto, el caso del boro, que consigue solamente por tres pares en el BF3, y el berilio sólo dos en el BeCl2. ¡Y en todos los casos se trata de moléculas estables! En otros casos, se trata de elementos más voluminosos, a partir del cuarto periodo de la tabla periódica, en donde intervienen en el enlace también electrones, no solo de la última capa, también de la penúltima.