2.1 Formación de los iones
|
RECUERDA:
|
 |
 |
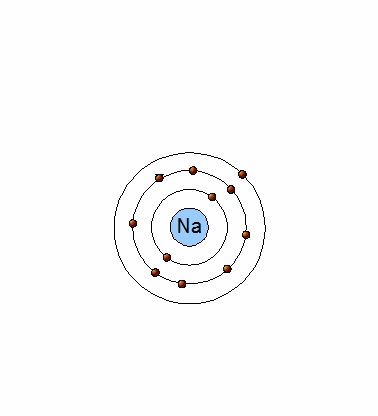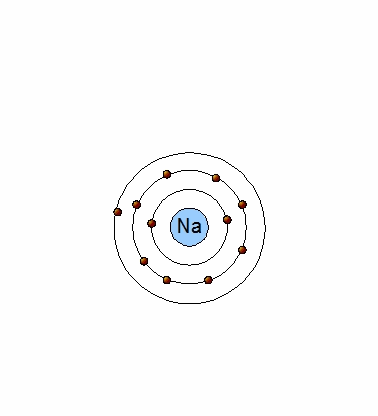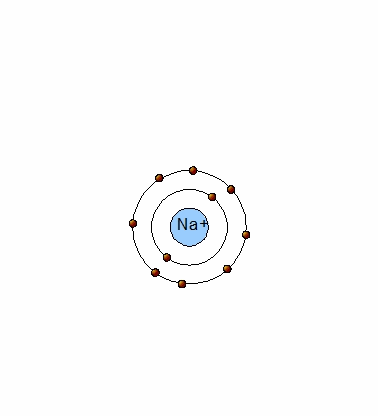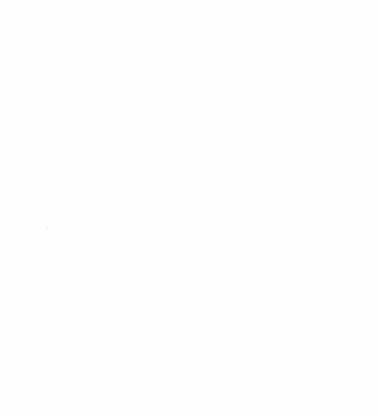
Ya debes tener claro que los gases nobles son estables y por ello son los únicos elementos que se presentan en forma de átomos aislados. Esta estabilidad se debe al número de electrones que tienen en el último nivel; 2 el Helio y 8 todos los demás.
 |
| Dominio público |
Sabemos que en la naturaleza todo tiende hacia un estado de máxima estabilidad o, lo que es lo mismo, de mínima energía. Por ejemplo, cuando colocamos a un niño en lo alto de un tobogán, se desliza hacia abajo hasta llegar a su base, porque allí es más estable debido a que tiene menos energía potencial (menos altura). Por el mismo motivo, un muelle estirado recupera por sí solo su forma inicial o una manzana se cae de su árbol.
Así, los átomos tienden a perder o a ganar electrones, para tener en su último nivel, el mismo número de ellos que el gas noble más próximo y ser más estable.
Un átomo de Na (11p+,11e-) tiene un electrón en su último nivel energético (Na:[Ne]3s1) y tiende a perderlo, ya que de esta manera, será estable como el neón y se transforma en un ion positivo (catión) al tener un protón en exceso: Na+(11p+,10e-).
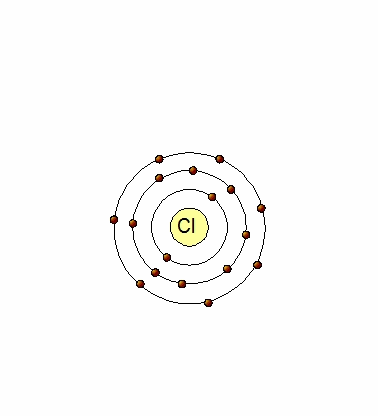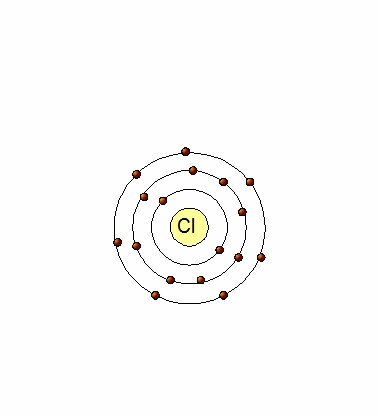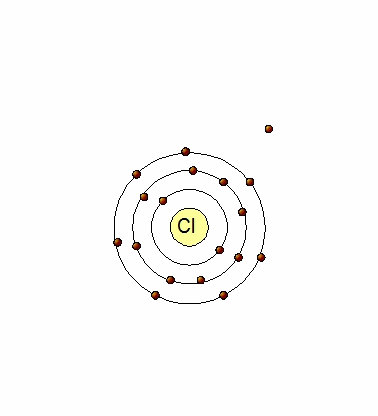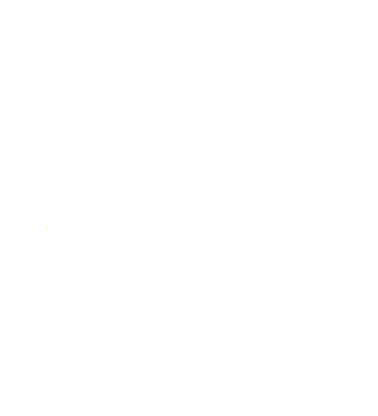
Un átomo de Cl (17p+,17e-) tiene 7 electrones en su último nivel (Cl:[Ne]3s23p5), por lo que tiene tendencia a captar un electrón para tener los mismos electrones que el Argón. Al hacerlo, se transforma en un ion negativo (anión) por tener un electrón en exceso Cl-(17p+,18e-).
Importante
Cuando un metal pierde electrones, se transforma en un ion positivo o catión.
Si un no metal capta electrones, se transforma en un ion negativo o anión.