1.1 Metales y no metales
Pre-conocimiento
¿Recuerdas lo que es la configuración electrónica de los átomos?.
Decíamos que conocer la configuración electrónica de los átomos era muy importante, pues permitía predecir las propiedades químicas del elemento. Pues fíjate si es importante la configuración electrónica que también determina los enlaces que tienen lugar y el tipo de enlace con otros átomos.
En este tema nos va a interesar sobretodo la configuración electrónica de la última capa, llamada capa de valencia.
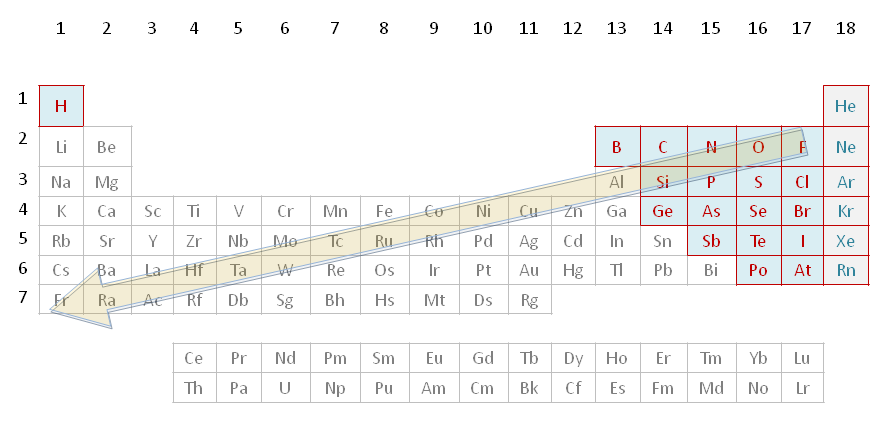
Recuerda también que todos los elementos del sistema periódico, pueden clasificarse según un criterio muy sencillo, en metales y no metales, aparte de los gases nobles.
- Metales: los átomos metálicos son aquellos que tienen pocos electrones en la última capa (capa de valencia) y además tienen mucha tendencia a perderlos para ser más estables. Los átomos metálicos tienen tendencia a perder los pocos electrones que tienen en la última capa, consiguiendo así la configuración electrónica del gas noble más próximo. Cuando pierden electrones adquieren una carga positiva neta, por eso decimos que son electropositivos.
- No metales: Son los elementos que no son metales. Si atendemos a su estructura electrónica, se puede observar que poseen en su última capa bastantes electrones y no tienen tendencia a perderlos, sino más bien tienen tendencia a aceptar otros electrones para tener los mismos que el gas noble más cercano. Como tienen tendencia a captar electrones se dice que son electronegativos.
 |
| Imagen de elaboración propia |
Esta clasificación en metales y no metales es muy útil a la hora de estudiar el enlace, pues dependiendo del carácter de los elementos que van a formar el enlace, se puede predecir el tipo de enlace que tendrá lugar.
| Metales | Enlace metálico. Los átomos que van a formar enlace, tienen tendencia a perder electrones y de ninguna manera tienen tendencia a aceptarlos, por lo que todos los átomos pierden los electrones de la capa de valencia, y se ordenan en una red, inmersa en la nube que forman los electrones. |
| Metal y no metal |
Enlace iónico. Los átomos del elemento metálico tienen tendencia a perder electrones y los del no metal tienen tendencia a ganarlos, por lo que se forman iones positivos y negativos que se sitúan ordenadamente formando una red cristalina. |
| No metales | Enlace covalente. Los átomos de los elementos no metálicos tienen tendencia a aceptar electrones, pero como no hay átomos con tendencia a perderlos, lo que ocurre es que los átomos se aproximan y comparten los electrones. |