2.1 Medida del calor
Cuando se transfiere energía en forma de calor a un cuerpo, su temperatura aumenta como consecuencia del incremento de la energía cinética media de sus partículas. ¿Cómo podemos cuantificar la cantidad de energía transferida en estos procesos?
Dado que, como has visto, el calor es una forma de energía, su unidad en el sistema internacional será el julio (J), aunque existe otra unidad de uso habitual en la medida del calor: la caloría.
Actividad
El calor se mide en el S.I. en julios (J), pero también en calorías (cal). Una caloría se define como la energía necesaria para elevar un grado la temperatura de un gramo de agua. La relación entre julio y caloría es:
1 cal = 4.18 J
Ya has visto que no todos los cuerpos se calientan de la misma manera cuando los sometemos a una fuente de calor.
Si se transfiere una misma cantidad de calor a dos sistemas distintos,
el aumento de temperatura experimentado por cada uno de ellos no es
siempre el mismo, sino que depende de su naturaleza y composición. El
parámetro que relaciona el incremento de la temperatura con el calor
suministrado se denomina calor específico (ce),
definido como la energía absorbida al calentarse por un kilogramo de
una sustancia para elevar su temperatura un grado, y es característico
de cada sustancia. El calor específico se mide en el S.I. en J/(kg·K).
El aumento de temperatura viene dado por tanto por el cociente: 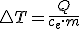 , de modo que el calor intercambiado puede escribirse como:
, de modo que el calor intercambiado puede escribirse como: 
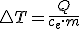 , de modo que el calor intercambiado puede escribirse como:
, de modo que el calor intercambiado puede escribirse como: 
Actividad
La energía transferida a un cuerpo de masa m para que su temperatura pase de una inicial (Ti) a otra final (Tf) viene dada por la expresión:
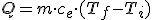
donde ce es el calor específico de la sustancia en cuestión.
Destacar también que, debido a que aparece una diferencia de temperaturas, es equivalente utilizar la escala Kelvin que la Celsius, pues según se ha visto, ambos grados son equivalentes.
Esta relación explica por qué es necesario suministrar más calor a unas sustancias que a otras para aumentar su temperatura: cuanto mayor sea su calor específico, más energía será necesario suministrar. Por ejemplo, los metales tienen un calor específico relativamente bajo, mientras que la madera o el agua lo tienen elevado.
Ejemplo o ejercicio resuelto
Un cazo contiene un litro de agua a 25 ºC. Si el calor específico del agua es de 4180 J/(kg·K), calcula la cantidad de energía necesaria para llevar todo el agua a la temperatura de ebullición (100 ºC).
AV - Reflexión
Cuando suministramos 50 kJ en forma de calor a un bloque metálico, observamos que su temperatura aumenta 65 ºC. Si el calor específico del metal es de 450 J/(kg·K), ¿cuál es la masa del bloque?