Descripción de la tarea

1. a) [Septiembre 2018] Contesta a la siguiente pregunta: el NaCl es la unión del cloro (Z=17) y el sodio (Z = 11). Dadas sus posiciones en el Sistema Periódico, predice las propiedades del compuesto formado.
b) [Junio 2017] Dados los siguientes elementos: sodio (Z = 11) y flúor (Z = 9), explica el tipo de enlace que se forma en la unión de estas especies.
2. Los números atómicos de dos elementos X e Y son, respectivamente, 9 y 20.
a) Indica el nombre y el símbolo de cada elemento.
b) Escribe sus configuraciones electrónicas.
c) Indica la fórmula del ion más estable de cada uno de ellos.
d) ¿Qué tipo de enlace se dará entre X e Y?
e) Escribe la fórmula del compuesto que se origina cuando se unen X e Y.
3. Dibuja el diagrama de Lewis e indica la geometría de las siguientes moléculas utilizando la teoría RPECV:
a) Dióxido de carbono (Cl2O).
b) Ácido cianhídrico (HCN).
c) Fosfina (PH3).
d) Trihiduro de boro (BH3).
4. Indica si las siguientes afirmaciones son verdaderas o falsas:
a) Un enlace es polar cuando los átomos que lo forman tienen la misma electronegatividad.
b) Todas las moléculas polares están formadas por enlaces polares.
c) Una molécula formada por enlaces polares puede ser apolar.
5. [Septiembre 2012] Las configuraciones electrónicas del magnesio y del cloro son:
Mg: 1s2 2s2 2p6 3s2
Cl: 1s2 2s2 2p6 3s2 3p5
a) Escriba la estructura de Lewis para el compuesto formado por la unión de ambos elementos.
b) Discuta si el tipo de enlace que presenta el compuesto es iónico, covalente o metálico.
c) Justifique las propiedades generales del compuesto en función del tipo de enlace que presenta.
6. La molécula BCl3 es apolar mientras que la de amoníaco (NH3) es polar. Explica por qué.
7. Ordena los siguientes compuestos de menor a mayor energía reticular y justifica la ordenación que propones: KBr, KCl, KI, KF.
8. Explica, en función del tipo de enlace, por qué:
a) El hierro es duro y denso.
b) El cloruro de sodio conduce la electricidad en disolución.
c) Se pueden obtener planchas de cobre.
d) Los circuitos eléctricos se construyen con hilos de cobre.
9. [Junio 2009] El oro y el oxígeno son un metal y un no metal. Completa la tabla siguiente, indicando en cada celda la propiedad correspondiente al compuesto formado por la combinación de átomos indicado en la celda de la primera columna.
| Enlace (iónico, covalente o metálico) |
Estado físico a temperatura ambiente (sólido, líquido o gas) |
Conductividad eléctrica |
Conductividad térmica | Fragilidad, ductilidad, maleabilidad,... | |
| Átomos de oro unidos entre sí | |||||
| Átomos de oxígeno unidos entre sí | |||||
| Átomos de oro unidos con átomos de oxígeno |
10. [Junio 2010] A continuación se muestran los tres primeros periodos del sistema periódico. Se representan con fondo oscuro los elementos metálicos y con fondo claro los no metálicos.
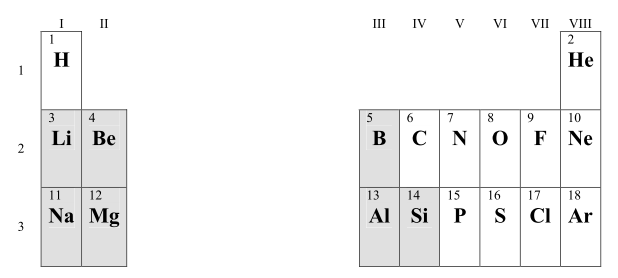
a) ¿Cómo será el enlace en el NaCl?
b) Representa el diagrama de Lewis para el CH4.
c) De estas sustancias NaCl, H2O, CH4 , ¿cuál presenta mayor dureza? ¿Cuál es más volátil?
d) ¿En alguna de las sustancias anteriores se forman puentes de hidrógeno?
11. [Septiembre 2015] Dados los compuestos NaF, CH4 y CH3OH, da respuesta a los siguientes apartados:
a) Indica el tipo de enlace que predomina en ellos.
b) Ordena de mayor a menor según su punto de ebullición. Razona la respuesta.
12. [Septiembre 2014] Para las siguientes sustancias: cloruro de sodio, agua, oxígeno y cobre:
a) Ordénalas en función de sus puntos de fusión, justificando brevemente la respuesta con el tipo de enlace y fuerzas intermoleculares presentes en cada una de ellas.
b) Indica cuales de ellas están constituidas en estado sólido por moléculas, cuáles por átomos y cuáles por iones.
13. [Septiembre 2017] Indica si las siguientes afirmaciones son verdaderas (V) o falsas (F). Justifica tu respuesta.
[ ] La conductividad eléctrica es la propiedad más característica de las sustancias iónicas.
[ ] Todas las sustancias cristalinas son metálicas.
[ ] El punto de ebullición del agua es anormalmente alto por la existencia de puentes de hidrógeno.
[ ] El cloruro de sodio es duro pero frágil.
14. [Junio 2018] Uno de los gases responsables del preocupante efecto invernadero es el dióxido de carbono. Sabiendo que se trata de una molécula de geometría lineal, responde a los siguientes apartados:
a) Justifica su enlace químico y representa su diagrama de Lewis.
b) Explica su polaridad.
c) ¿Crees que será soluble en agua? Justifica tu respuesta.
d) Nombra el tipo de fuerzas intermoleculares que existirá entre las moléculas de CO2.
Datos: Números atómicos: C=6; O=8

A la hora de resolver la tarea, debes elaborar un documento con el resultado de la tarea y enviárselo a tu profesor/a. Puedes utilizar esta plantilla para su desarrollo, aunque también puedes elaborar tu propia plantilla. Si haces esto último, debes indicar el enunciado de cada uno de los apartados previo a su resolución. Recuerda, al guardar la plantilla en tu ordenador, cambiar el nombre al documento incluyendo tu nombre y apellidos siguiendo este modelo apellido1_apellido2_nombre_PACQU_U2_T3.
Si quieres elaborar esquemas o dibujos, puedes hacerlos manualmente, escanearlos e insertarlos en el documento de texto.