2. Redes cristalinas.
En general los sólidos de la naturaleza son cristalinos lo que implica que los iones, átomos o moléculas que los constituyen se ordenan geométricamente en el espacio. En ocasiones esta estructura ordenada no es apreciable a simple vista porque están formados por una agrupación de microcristales orientados de formas diversas dando lugar a estructuras policristalinas, aparentemente amorfas.
Actividad
 |
| Imagen de E.L.U.E bajo licencia CC |
Las redes cristalinas se caracterizan fundamentalmente por un orden o periodicidad.
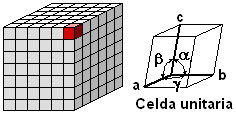
La estructura interna de los cristales viene representada por la llamada celdilla unidad o elemental que es el menor conjunto de átomos que mantienen las mismas propiedades geométricas de la red y que al expandirse en las tres direcciones del espacio constituyen una red cristalina.
El tamaño de esta celdilla viene determinado por la longitud de sus tres aristas (a, b, c), y la forma por el valor de los ángulos entre dichas aristas ( α, β , γ ).
AV - Pregunta de Elección Múltiple
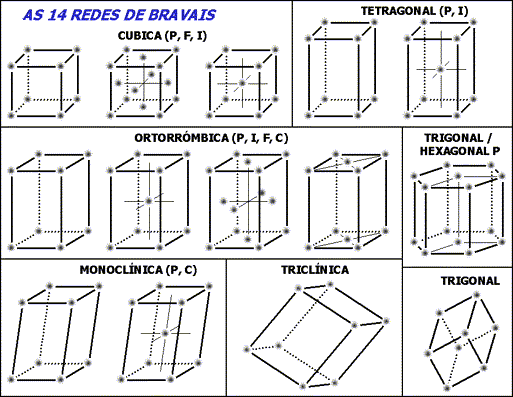
De las catorce redes de Bravais, casi todos los metales elementales y aleaciones metálicas, cristalizan en los siguientes tres tipos:
BCC, FCC y HCP
 |
|
Imagen de Cdang en Wikimedia Commons bajo licencia CC |
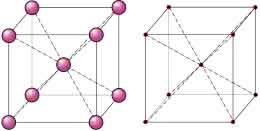
Red Cúbica Centrada en el Cuerpo (BCC, Body Centred Cubic)
La red representa un cubo cuyo parámetros son:
- aristas: a = b = c
- ángulos entre aristas: α = β = γ = 90°
- cantidad de átomos: 8 átomos en los vértices del cubo y 1 átomo en el centro del cubo.
EJEMPLOS: Feα, Mo, Na, ...
 |
|
Imagen de Cdang en Wikimedia Commons bajo licencia CC |
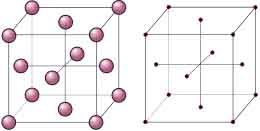
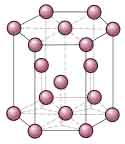
Red Cúbica centrada en las Caras (FCC, Face Centred Cubic)
La red tiene forma de cubo, cuyos parámetros son:
- aristas: a = b = c
- ángulos entre aristas: α = β = γ = 90°
- cantidad de átomos: 8 átomos en los vértices del cubo y 6 en los centros de cada una de las caras.
EJEMPLOS: Feγ, Ni, Co, Cu, Al, Ti, ...
 |
|
Imagen deCdang en Wikimedia Commons bajo licencia CC. |
Red Hexagonal Compacta (HCP, Hexagonal Close Packing)
La red tiene forma de prisma recto de base es un hexaedro, cuyos parámetros son:
- aristas: a = b ≠ c
- ángulos entre aristas: α = β = 90°; γ = 120°
- cantidad de átomos: 12 átomos están dispuestos en los vértices de la red, 2 átomos en el centro de la base y 3 átomos en el interior de la red.
EJEMPLOS: Ti, Co, Cd, Mg, ...
AV - Pregunta Verdadero-Falso
Retroalimentación
Verdadero
Uno en cada uno de los vértices, suman 8 en total.Retroalimentación
Falso
Solo hay un átomo en centro de cada cubo.Retroalimentación
Falso
No, se abrevia como BCC, que proviene del inglés Body Centred Cubic