4. Procesos electrolíticos
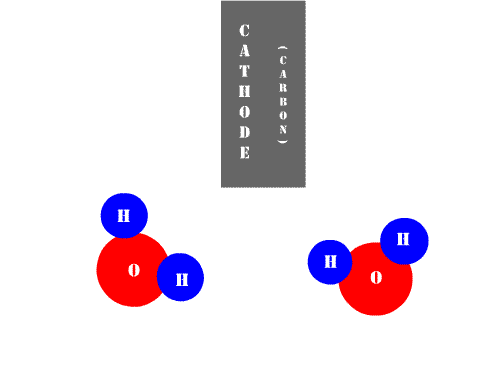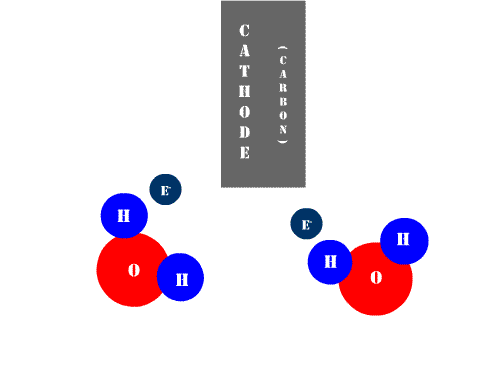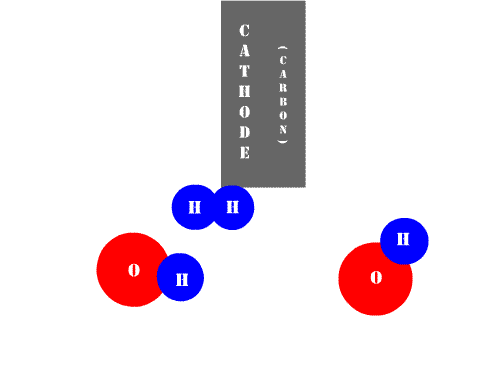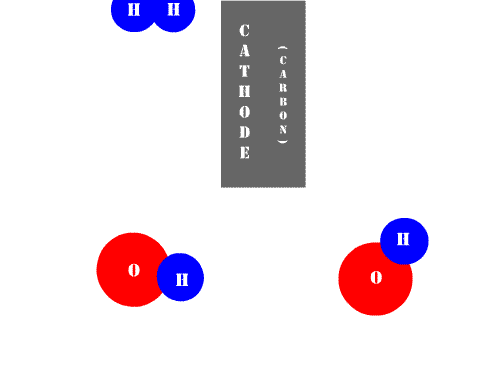 |
| Animación de Benrr101 en Wikimedia Commons. CC |
En los apartados anteriores has aprendido sobre los procesos de reacción y reducción, , y ahora eres capaz de explicar por qué se producen ciertas reacciones redox de forma espontánea y otras no.
Y una vez que sabes que una reacción redox se produce, has aprendido el método para obtener energía eléctrica de ellas, conoces también el montaje de una pila.
Pero ¿y al revés?, ¿es posible producir reacciones químicas que, de forma natural, son no espontáneas, utilizando corriente eléctrica?
Como ya sabes, la Electroquímica estudia la relación entre reacciones químicas y corriente eléctrica. Veamos ahora las reacciones no espontáneas que necesitan de un aporte de energía eléctrica para que se lleven a cabo.
Mientras que las células o células galvánicas son dispositivos que, al consumir energía química, generan energía eléctrica, la cuba electrolítica representa justamente el fenómeno opuesto. En la Electrolisis se consume energía eléctrica para llevar a cabo una reacción química no espontánea. Así, definimos: electrolisis es el proceso redox que necesita una corriente eléctrica para producir una reacción química.
Actividad
Electrolisis
Es el proceso redox que necesita una corriente eléctrica para producir una reacción química.