4.1 Cubas electrolíticas
En las cubas electrolíticas se producen reacciones redox no espontáneas. La energía necesaria se aporta en forma de energía eléctrica. Es decir, se trata del proceso inverso de las pilas electroquímicas.
En la tabla puedes ver la comparación de las características de una pila y de una cuba electrolítica:
| Pila voltaica | Cuba electrolítica |
| La reacción redox es espontánea | La reacción redox no espontánea |
| La reacción química produce una corriente eléctrica | La corriente eléctrica produce una reacción química |
| Se convierte la energía química en eléctrica | Se convierte la energía eléctrica en química |
| El ánodo es el polo negativo El cátodo es el polo positivo |
El ánodo es el polo positivo El cátodo es el polo negativo |
| La reducción se da en el cátodo | La reducción se da en el cátodo |
| Hay dos electrolitos | Hay un solo electrolito |
Uno de los procesos electrolíticos más conocidos es la descomposición del agua en sus elementos. Para ello, se añade un poco de ácido sulfúrico al agua para que conduzca la corriente eléctrica, y se hace el montaje de la figura. Fíjate en que el volumen de H2 desprendido es el doble que el de O2, con lo que se demuestra la composición de la molécula de agua (doble cantidad de sustancia de un elemento que del otro).
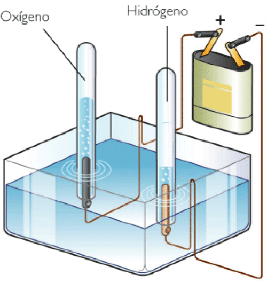 |
|
| Imagen Campillo, Uso educativo | Vídeo de Fqmanuel alojado en Youtube |
Electrolisis del NaCl fundido
En el cátodo, que en la cuba es el polo negativo, se produce la reducción del Na+ a Na(s), y en el ánodo, el polo positivo en la cuba, la oxidación del Cl- a cloro gas. Esta reacción no es espontánea: hay que suministrar energía por medio de la corriente eléctrica si se quiere descomponer 1 mol de NaCl. Como los productos obtenidos, Na(s) y Cl2(g), se recombinarían espontáneamente, se deben obtener por separado.
Electrolisis del NaCl disuelto
Si se electroliza una disolución de NaCl, los productos obtenidos son distintos, como puedes ver en el vídeo, ya que además de los iones Cl- y Na+ hay también iones H+ y OH-, que intervienen en el proceso redox total.
Objetivos
El proceso en que un metal X se deposita en un electrodo por procedimientos electrolíticos se puede representar mediante la ecuación Xn+ (aq) + n e- → X (s), lo que significa que por cada mol de X depositado circularán n moles de electrones.
En 1832 el físico inglés M. Faraday establece la ley que lleva su nombre, y permite determinar la cantidad de producto que se desprende, tanto en el cátodo, caso de la deposición de metales, como en el ánodo, caso de los gases.
La relación es la siguiente:
![]()
Como la proporción de reacción es constante, si circula una intensidad de corriente I durante un tiempo t, la carga eléctrica Q será Q = I t y depositará una masa m del metal de masa molar M (F es la constante de Faraday y toma el valor 96500 C·mol-1).
En el esquema puedes ver la ley de Faraday, indicándose en cada caso la magnitud y su unidad.
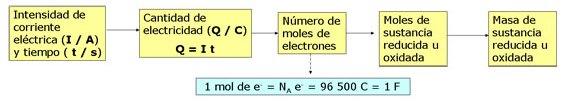
Objetivos
 |
| Imagen de Henning, CC0 |
Recubrimientos metálicos
La electrolisis posee muchas aplicaciones de interés industrial y comercial. La galvanoplastia es una de las aplicaciones más importantes. Consiste en aplicar una delgada capa de metal sobre una superficie conductora de corriente: el cromado da a los metales una superficie brillante, el acero se galvaniza con cinc para protegerlo de la corrosión, los metales se platean o doran por galvanoplastia, etc.
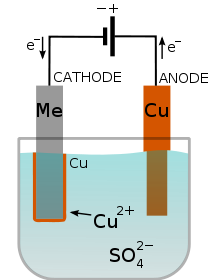
El objeto que va a recubrirse hace de cátodo en el circuito, y se sumerge en un baño electrolítico que contiene los iones que se desea depositar. Controlando la intensidad de la corriente y el tiempo de electrolisis se puede fijar el espesor y cantidad de capa depositada.
En la imagen puedes ver el cobreado de un metal: se oxida el cobre del ánodo, que pasa en forma de iones a la disolución, y se deposita en el cátodo sobre el metal a recubrir de cobre.