3. Producción de corriente eléctrica por redox: pilas
Todos sabemos que el hierro se oxida por acción del aire y del agua, dando lugar a óxido e hidróxido de hierro, en los que hay iones Fe2+ o Fe3+.
¿Cómo puedes explicar que se produzca esta reacción redox? ¿Es posible predecir si una reacción redox se va a producir o no?
Y una vez que sabes que una reacción redox se produce, ¿cómo se puede aprovechar para obtener energía eléctrica? Es decir, ¿cómo se monta una pila? Y al revés, ¿cómo se pueden producir reacciones químicas no espontáneas utilizando corriente eléctrica?
La Electroquímica estudia la relación entre reacciones químicas y corriente eléctrica, como vas a ver en este apartado y el siguiente.
Observa la reacción redox producida al sumergir una lámina de cinc en una disolución de sulfato de cobre (II), que se encuentra formando iones Cu2+(aq) y SO42-(aq). El color azul de la disolución va desapareciendo y la lámina de cinc queda recubierta por un depósito rojizo-negruzco de cobre metálico. Se produce espontáneamente la reacción: Zn (s) + Cu2+(aq) → Zn2+ (aq) + Cu (s).
 |
| Imagen de elaboración propia |
La diferencia de energía entre reaccionantes y productos de una reacción redox que se produce espontáneamente se desprende en forma de calor, y se puede aprovechar convirtiéndola en energía eléctrica. Para ello es necesario forzar a los electrones a pasar por un circuito eléctrico externo. Esto se consigue separando físicamente los dos procesos de la reacción de tal forma que tengan lugar en dos compartimentos distintos. De esta forma se obliga a los electrones que se liberan en el ánodo (donde se produce la oxidación) a pasar a través de un hilo conductor u otro circuito eléctrico (lámpara, amperímetro, etc.) por el que circulará entonces una corriente eléctrica, antes de que se capten en el cátodo (en el que se produce la reducción).
Estos sistemas en los que se transforma energía química en energía eléctrica se llaman pilas electroquímicas, pilas galvánicas o sencillamente pilas.
En la imagen tienes el esquema de la pila Daniell, en la que se da la reacción Zn(s) + Cu2+(aq) ↔ Zn2+(aq) + Cu(s). Los electrones que circulan (en definitiva, la corriente eléctrica) hacen que se encienda la bombilla.
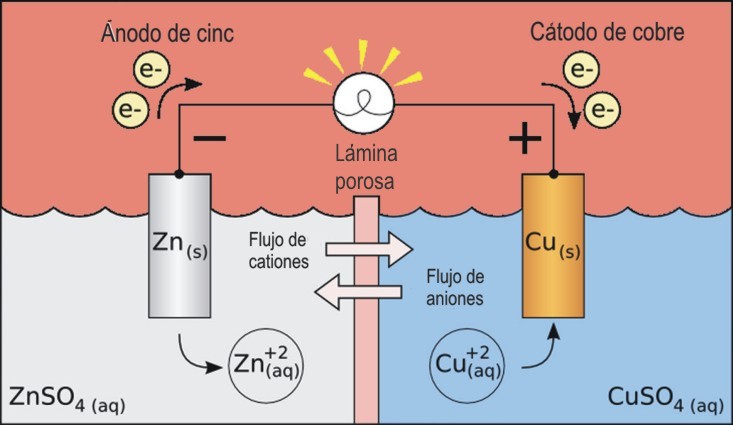 |
| Imagen de Larrucea en Wikimedia. CC |
Descripción de una pila
Las dos láminas metálicas se llaman electrodos. Aquel en el que se produce la oxidación, que por convenio se sitúa a la izquierda, recibe el nombre de ánodo, y cátodo el otro electrodo, en el que se produce la reducción.
La separación de los dos procesos puede efectuarse mediante:
a) un tabique poroso (por ejemplo, de porcelana).
b) realizándolos en dos recipientes distintos, unidos por un puente salino, que es un tubo de vidrio que contiene una disolución concentrada de un electrólito inerte respecto al proceso redox.
Por ambos métodos se impide que se mezclen las disoluciones anódica y catódica, pero se permite la conducción de los iones.
El puente salino o el tabique poroso tienen dos funciones:
- Cerrar el circuito, ya que permite la circulación de iones a través de ellos.
- Mantener la neutralidad eléctrica de las disoluciones de cada parte de la pila la cantidad de iones cinc va aumentando, con lo que el recipiente de la izquierda quedaría con carga positiva, impidiendo la salida de los electrones, que quedarían atraídos; por tanto, pasan iones negativos al recipiente de la izquierda para mantenerlo neutro.
Actividad
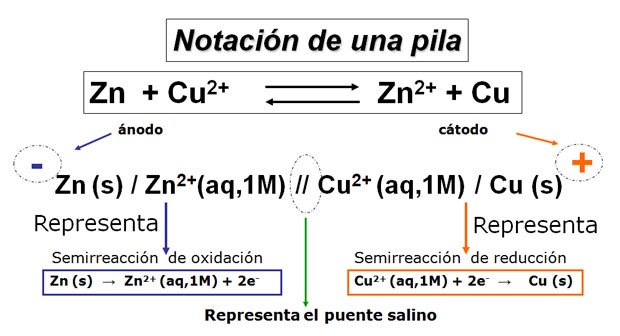 |
| Imagen de elaboración propia |
Ejemplo o ejercicio resuelto
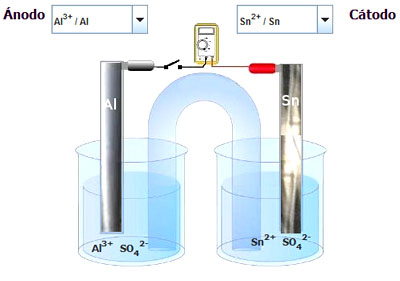 |
| Imagen de elaboración propia |
En la imagen tienes una pila diferente de la pila Daniell. Eso sí, su funcionamiento es el mismo.
a) Escribe la reacción que se produce en cada electrodo.
b) Escribe la reacción de pila.
c) Indica qué iones saldrán del puente salino de NaCl hacia cada recipiente.