2. Oxidantes y reductores. Pares redox
Un oxidante es una especie química (átomo, molécula o ion) que produce la oxidación de otra, llamada reductor.
Ahora bien, para que una sustancia oxide a otra tiene que captar electrones, que provienen de esa otra sustancia, por lo que disminuirá su número de oxidación y por tanto, ella misma se reducirá. Y a la inversa, el reductor tiene que ceder electrones y, por tanto, se oxida. Las reacciones redox ocurren, pues, entre parejas de oxidación-reducción, llamadas pares conjugados de oxidación reducción o, simplemente, pares redox:
oxidante1 + reductor2 ↔ reductor1 + oxidante2
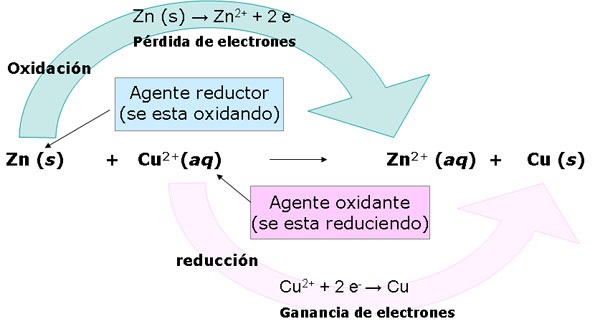 |
| Imagen de elaboración propia |
Seguro que todo esto te recuerda a las reacciones ácido-base. El paralelismo entre los pares conjugados ácido-base (según la teoría de Brönsted-Lowry) y los pares redox se ve claramente en el cuadro siguiente:
| Ácido - base | Redox | |
| Transferencia de | protones | electrones |
| Donador | ácido | reductor |
| Aceptor | base | oxidante |
Actividad
Oxidantes y reductores
Oxidante: sustancia que oxida a otra, por lo tanto se reduce y contiene un elemento cuyo número de oxidación disminuye.
Reductor: sustancia que reduce a otra, por lo tanto se oxida y contiene un elemento cuyo número de oxidación aumenta.
Ejemplo o ejercicio resuelto
La reacción del amoniaco con el hipoclorito presente en la lejía produce un gas muy tóxico, la cloroamina, NH2Cl(g) :
NH3(g) + ClO-(aq) → NH2Cl(g) + OH-(aq)
Por otro lado, cuando el salfumán se mezcla con lejía, se produce cloro, un gas muy venenoso:
H+(aq) + Cl-(aq) + ClO-(aq) → Cl2(g) + H2O(l)
Identifica los pares redox en cada uno de los procesos, e indica en cada caso la variación producida en los números de oxidación.