2.3 Afinidad electrónica
Importante
Existirán afinidades electrónicas negativas (energía desprendida) o positivas (energía absorbida).
Importante
La afinidad electrónica (o electroafinidad) es una propiedad periódica que sigue la variación propia de la energía de ionización, ya que si un átomo tiene baja energía de ionización es que cede fácilmente el electrón y por tanto no tiende a ganarlo, siendo así su afinidad electrónica baja (en valor absoluto). Por el contrario, si la EI es alta, el átomo no tendrá tendencia a perder electrones y sí a ganarlos teniendo por tanto una AE alta (valor absoluto). Por tanto:
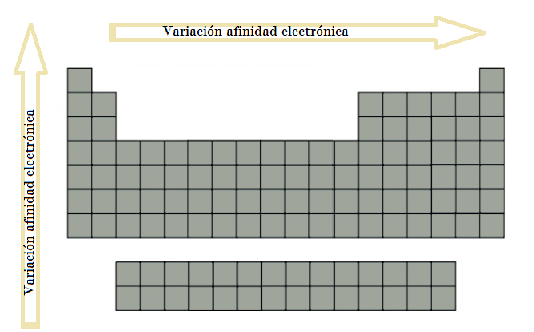
En un periodo: como el radio atómico disminuye al avanzar en un periodo, los electrones se ven atraídos con más fuerza. En consecuencia, la afinidad electrónica aumenta al desplazarnos a lo largo de un periodo.
- En un grupo: al descender en el grupo, el radio atómico aumenta y por el mismo razonamiento, la afinidad electrónica disminuye al descender en un grupo.
En resumen, la variación de la afinidad electrónica referida a la posición en la tabla periódica puede observarse en la siguiente imagen, donde la flecha indica el aumento de la afinidad electrónica:
 |
| Imagen de elaboración propia |