2.1 Tamaño de los átomos e iones
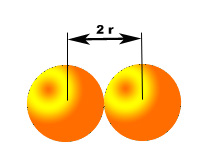 |
| Imagen de elaboración propia |
Actividad
El radio atómico es una propiedad periódica que varía de la siguiente forma:
En un grupo: dado que el radio atómico depende de la distancia al núcleo del electrón más externo, éste aumenta con el número atómico (Z). Como al descender en un grupo Z aumenta, el radio atómico es mayor. Además esta variación se ve reforzada puesto que con valores mayores de Z, al aumentar el número de capas electrónicas, la atracción del núcleo queda apantallada y los electrones externos se ven menos atraídos, alejándose más y provocando un aumento en el radio atómico. Así pues, el radio atómico aumenta conforme descendemos en un grupo.
En un periodo: el radio atómico disminuye al aumentar el número atómico, pues aunque el último electrón se encuentre en el mismo nivel energético (capa), el núcleo tiene un protón más, de forma que lo atrae con más fuerza. Por tanto, el radio atómico disminuye conforme avanzamos en un periodo.
En resumen, la variación del radio atómico referida a la posición en la tabla periódica puede observarse en la siguiente imagen, donde la flecha indica el aumento del radio:
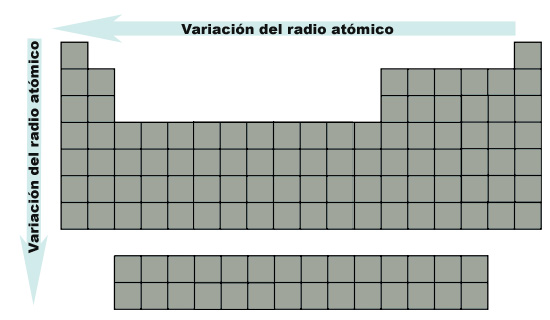 |
| Imagen de elaboración propia |
AV - Reflexión
Ordena según su tamaño los átomos siguientes:
N, Be, C, He, F
 |
| Imagen de Grupo Lentiscal, Uso educativo |
El tamaño de los iones
Hay elementos que forman iones positivos (cationes), perdiendo electrones, mientras que otros los ganan, formando iones negativos (aniones).
En ambos casos, varía la relación entre protones y electrones; es decir, varía la carga nuclear efectiva. Por ejemplo, el sodio tiene la estructura electrónica 1s2 2s2 2p6 3s1, con once electrones en total. Forma el ión Na+ al perder un electrón: la carga nuclear efectiva pasa de ser 11p/11e a ser de 11p/10e, con lo que los electrones están más atraídos y quedan más cerca del núcleo, con lo que el tamaño disminuye.
Al formarse un catión siempre se produce este efecto de aumento de carga nuclear efectiva y disminución de tamaño.
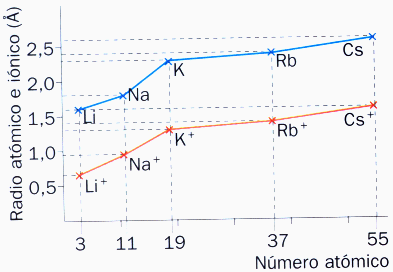
En el caso de los elementos alcalinos, al perder el único electrón que tienen en la capa más externa queda como última capa ocupada la capa anterior, con lo que el tamaño se hace aún menor. Lo mismo sucede con los alcalinotérreos al perder los dos electrones que tienen en su última capa.
Fíjate en la imagen la comparación de tamaños de los átomos y los iones de los elementos alcalinos.
¿Qué sucede con los aniones? Cuando un átomo gana electrones, la carga nuclear efectiva disminuye, con lo que el tamaño siempre aumenta, y más cuantos más electrones gana.
AV - Reflexión
Ordena en función de su tamaño las siguientes especies químicas:
Na+, Ne, O2-, Mg2+ y F-